البروتين القادر على إذابة الأورام السرطانية اُكتشف في جامعة فاندربيلت
بقلم ماريسا شابيرو
27 يناير 2021
المترجم: عدنان أحمد الحاجي
المقالة رقم 32 لسنة 2021
A protein that can melt tumors discovered at Vanderbilt
Marissa Shapiro
Jan. 27,2021

للمرة الثانية، باحثو السرطان في جامعة ڤاندربيلت اكتشفوا بروتينًا - عندما يتم التلاعب به جينيًا لمنعه من التفاعل مع الجين المسؤول عن تكوِّن السرطان - يُذوِّب الأورام السرطانية في غضون أيام وبشكل فعال.
الورقة نشرت في مجلة eLIFE في 8 يناير 2021 «1».
ويليام تانسي William Tansey، برفسور الخلية والبيولوجيا التطورية والكيمياء الحيوية، ملتزم بفهم كيف يعمل الجين المنظم MYC للجين الورمي «انظر 2 و3». البروتين شديد الحفظ [شديد الحفظ: يعني انه لم يتغير من خلال الاصطفاء الطبيعي بمرور السنين] والشبيه بالمعكرونة [في تشابكه] يؤدي وظائف مهمة في التطور البشري الطبيعي، وغالبًا ما يتم إعادة تنشيطه في السرطانات الأكثر فتكًا والأكثر صعوبة على العلاج.
”أصبح جين ال MYC بمثابة الدافع الذي وراء دورات دؤوبة من استنساخ الخلايا وانقسامها“. ”كلما زادت سرعة نمو الخلايا وانقسامها، تراكمت الطفرات، مما يؤدي ذلك إلى نمو السرطان،“ كما يقول تانسي.
يقول تانسي إن جين ال MYC كان هدفًا دوائيًا متملصًا لمدة 30 عامًا على الأقل، واعتبر ”غير قابل للارتباط مع الدواء undruggable [كما فهمناه من 4]“ بسبب افتقاره إلى البنية [ليس له جيوب أو أخاديد في بنيته تساعد على الارتباط به، راجع 4]. للتغلب على هذا المانع، شرع تانسي في التعرف على بروتينات شريكة أكثر تنظيمًا لجين ال MYC بهدف هندسة طفرات تعطل تفاعلات الشركاء مع جين ال MYC التي تسبب نمو السرطان. ”إذا تمكنا من التحقق من صحة الاتصال / الارتباط المادي بين جين ال MYC والبروتين، يمكننا أن نلاحقه علاجيًا“ كما قال تانسي.
تعرف تانسي ومعاونوه على بروتين يدعى Host Cell Factor-1 كمرشح حاسم لهذا النوع من التطوير العلاجي. بروتين HCF1 يُلامس بجين ال MYC وهو مهم لتحفيز تخليق البروتين. عندما تُصمم خلية سرطانية مع جين ال MYC جينيًا بحيث لا تتفاعل مع بروتين ال HCF1، تبدأ الخلية السرطانية في التدمير الذاتي. يعد تطوير علاج يحد من هذا التفاعل خطوة واعدة للغاية في علاج السرطان.
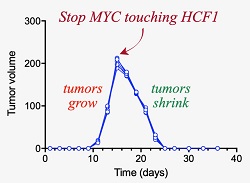
الشكل: التجربة التي اجريت أظهرت ستة أحجام للورم نمت في مدة 15 يومًا، وعند هذه النقطة تم وقف تفاعل بروتين ال MYC-HCF1. بعد اليوم الخامس عشر، تقلصت الأورام السرطانية واختفت. الخلايا السرطانية ماتت في أربعة أيام. - وليام تانسي
”المثير للاهتمام هو أننا لسنا بحاجة إلى إزالة جميع وظائف جين ال MYC“. ”كنا فقط بحاجة فقط لمتابعة تفاعل محدد للغاية،“ كما قال تانسي.
هذا هو البروتين الثاني الذي اكتشفه تانسي والذي يستجيب لجين ال MYC. اكتشاف سابق لبروتين WDR5 «انظر 5» بالتعاون مع ستيفن فيسيك Stephen Fesik، برفسور أبحاث السرطان، أظهر سلوكًا مشابهًا جدًا. كان كلا البروتينين موجودان لكنهما غير ملاحظيَن.
”يرتبط جين ال MYC ماديًا / فيزيائيًا بالحمض النووي لتنشيط الجينات. تحتاج عوامل استنساخ البروتين إلى مجالين فقط: مجال ربط الحمض النووي ومجال التنشيط الذي يحفز الحمض النووي لتخليق الحمض النووي الريبي والبروتينات. قال تانسي:“ نحن مهتمون بالجزء المتبقي، القطعة اليتيمة من البروتين التي لم تُعطى أي اعتبار جدي".
نتيجة أربع سنوات من العمل الجاد، يعتزم مختبر تانسي Tansey الحصول على فكرة أكبر عن كيف يعمل بروتين ال HCF1 مع جين ال MYC وكيف يؤثر على وظائف البروتين الأخرى.